JLK 'AI 뇌졸중 솔루션' FDA 승인…올해 'AI 제품' 3번째
'전립선·대혈관폐색' 장비 이어 'JLK-CTP'…'뇌관류MR' 제품 미국 인허가 신청 마치기도
JLK 'AI 뇌졸중 솔루션' FDA 승인…올해 'AI 제품' 3번째'전립선·대혈관폐색' 장비 이어 'JLK-CTP'…'뇌관류MR' 제품 미국 인허가 신청 마치기도의료 인공지능(AI) 국내사 JLK(대표 김동민)는 뇌졸중 솔루션 'JLK-CTP'가 미식품의약국(FDA) 510(k) 승인을 획득했다고 17일 밝혔다.
이로써 이 회사의 제품은 'JLK-PROSTATE(전립선)'와 'JLK-LVO(대혈관폐색)'에 이어 올해 3번째 FDA로부터 승인받았다.
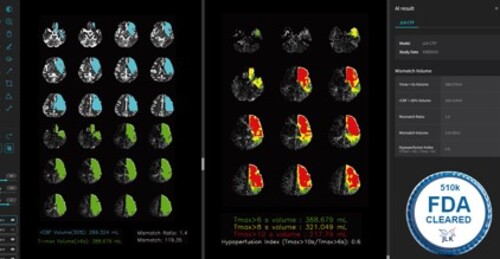
JLK-CTP는 뇌 CT 관류영상(CT Perfusion)에서 뇌혈류(CBF) 분석 결과를 기반으로 뇌경색 중심(Infarct core)과 뇌관류(Perfusion) 저하 영역의 부피를 자동으로 계산해 주는 솔루션으로, 뇌경색 발병 부위는 물론 손상 정도를 정밀하게 파악할 수 있는 데다, 회복 가능한 뇌의 범위와 뇌경색 부피(ischemic core)를 제공, 촌각을 다투는 뇌졸중 환자의 수술∙시술 시행 여부를 빠르게 판단할 수 있다고 이 회사는 설명했다.
이 회사는 지난 8월 'JLK-PWI(뇌관류MR)' 제품의 FDA 인허가 신청을 마친 상황으로 연내 3개의 뇌졸중 솔루션을 추가 신청할 계획이다.
김 대표는 "연이은 FDA 승인으로 제이엘케이 솔루션에 대한 미국 보건당국의 긍정적 반응을 확인할 수 있었다"며 "자사 AI 솔루션은 모두 글로벌 스탠더드 규격(ASA·AHA)에 맞게 개발돼 모든 제품들이 연결성을 갖고 있고, 각 솔루션들은 실질 임상과 연결돼 시너지 효과를 낼 수 있는 게 특징”이라고 말했다.
이어 "앞으로도 남아있는 FDA 인허가 신청을 차질없이 진행해 빠른 승인과 상용화로 미국 시장에서의 안정적 매출원을 확보하는 데 더 주력할 것"이라고 덧붙였다. <저작권자 ⓒ 뉴스맥 무단전재 및 재배포 금지>
댓글
|
많이 본 기사
|