한국애브비 이중항체 항암신약 '엡코리타맙 3상' 승인…림프종 연관
재발성 또는 불응성 미만성 거대 B세포 '병용 임상'…국내 병원 11곳 3상 맡아
'소포림프종' 적응증 추가 FDA 허가…신속심사 통해 환자 127명 대상 2상 근거
한국애브비 이중항체 항암신약 '엡코리타맙 3상' 승인…림프종 연관재발성 또는 불응성 미만성 거대 B세포 '병용 임상'…국내 병원 11곳 3상 맡아
|
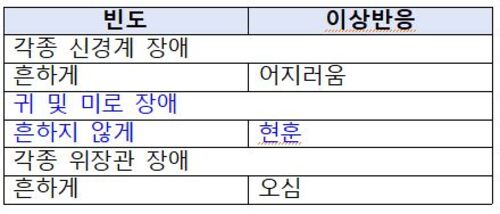
 자료 : 식약처 |
국내 의료기관에선 서울대 및 분당서울대, 서울아산, 삼성서울, 서울성모, 화순전남대, 동아대, 부산백, 계명대동산, 전북대, 울산대병원의 11곳이 3상을 맡는다.
이날 식약처 국내 3상 승인을 획득했던 엡코리타맙은 미식품의약국(FDA)으로부터 재발성 및 불응성 림프종(소포림프종)에 대한 허가를 받기도 했다.
FDA는 2회 이상 전신치료 경험이 있는 성인 재발·불응성 림프종(비호지킨림프종)에 대해 승인(적응증 추가)했다.
이는 신속심사를 통한 허가로, 관련 림프종 환자 127명을 대상으로 한 임상(2상) 결과 효능 및 안전성이 입증됐다.
이중 특이성 단클론항체로 평가받는 엡코리타맙은 작년 5월 FDA로부터 재발·불응성 미만성 거대 B세포 림프종 치료 적응증이 허가된 바 있다.
<저작권자 ⓒ 뉴스맥 무단전재 및 재배포 금지>
댓글
많이 본 기사