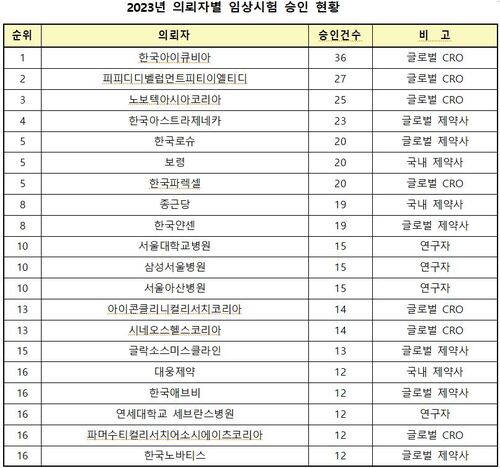
FDA 문 앞까지 간 '국내 톡신들', 번번이 통과 못했지만‥
휴젤 이어 메디톡스도 품목 허가 신청 반려, 일부 자료 안 갖춰져 보완 요청받아
'액상 보툴리눔' 협의 후 BLA 재제출 계획…재신청 '레티보'는 곧 승인 여부 결정
FDA 문 앞까지 간 '국내 톡신들', 번번이 통과 못했지만‥휴젤 이어 메디톡스도 품목 허가 신청 반려, 일부 자료 안 갖춰져 보완 요청받아
|
 메디톡스 '액상형 보툴리눔 톡신 제제 FDA 허가 신청 반려' 금감원 공시 |
메디톡스는 휴젤 등에 비해 비교적 빨리 허가 심사가 거절됐는데, 이 사유가 MT10109L와 연관된 특정 검증 시험 보고서 미비라고 밝혔다.
이에 회사 측은 휴젤처럼 BLA를 보완한 뒤 재신청할 계획이다.
회사 측은 이 사항과 관련해 FDA와 논의코자 협의 진행과 함께 협의 사항을 보완한 후 신청서를 다시 제출, 재공시한다는 설명이다.
MT10109L은 동물 유래 성분과 사람 혈청에서 추출한 알부민이 사용되지 않아 동물성 바이러스 감염 가능성을 차단한 톡신 제제로 작년 12월 미간 주름과 눈가주름 개선을 적응증으로 FDA 품목 허가가 신청됐었다.
한편 국내 톡신 제품 중엔 대웅제약의 '나보타'(미국 제품명 : 주보)가 5년 전 FDA로부터 처음 허가를 받고 연간 1,000억 넘는 매출(수출 비중 80%)로 성장세를 보이고 있다.