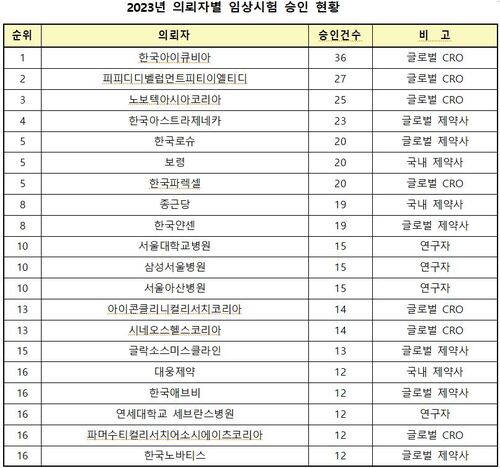
유한화학, 'FDA·브라질 ANVISA 실사' 통과…원료약 제조 글로벌 인정
유한양행 자회사, 수출 시스템 지적 사항 거의 없이 '무결점' 실사 마무리
안산공장 미국 인증 시작 화성 2공장도 선진GMP 적합 "'연속 생산' 도입"
유한화학, 'FDA·브라질 ANVISA 실사' 통과…원료약 제조 글로벌 인정유한양행 자회사, 수출 시스템 지적 사항 거의 없이 '무결점' 실사 마무리
|
 유한화학 화성공장 전경 <자료 : 유한양행> |
추후 이 회사는 생산 능력 확대에 따른 신규 고객사의 제품 수주와 규제 기관 및 고객사의 실사도 앞둬 질적 성장과 발전이 기대되고 있다.
회사 측은 "앞으로 글로벌 제약산업의 새로운 표준으로 자리잡을 '연속 생산(Continuous Manufacturing)' 시스템을 도입하기 위한 시설을 마련하는 등 고품질 원료약 생산을 위한 경쟁력 강화를 지속 추진 중”이라며 “저가 경쟁력으로 점차 사라져 가는 국내 원료약 제조 환경을 극복하고, 글로벌 핵심 원료 위탁개발 생산 기업의 리더(Global API CDMO Leader)가 되기 위해 노력을 다할 것”이라고 말했다.
연속 생산은 2개 이상의 단위 공정으로 구성된 통합 공정(시스템), 제조 장비에 지속 투입된 원료가 단위 공정을 거쳐 목표로 하는 반제품 또는 완제품으로 제조돼 지속 배출됨을 말한다.