국내 '고농도 휴미라 바이오시밀러' 미국 시판…허가 석달만
셀트리온 자가면역질환 치료제 '유플라이마' 80mg…작년 40mg 이어 1분기 내 소아용 20mg도 현지 선보일 계획
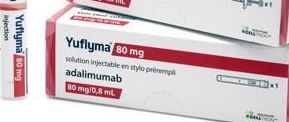
국내 '고농도 휴미라 바이오시밀러' 미국 시판…허가 석달만셀트리온 자가면역질환 치료제 '유플라이마' 80mg…작년 40mg 이어 1분기 내 소아용 20mg도 현지 선보일 계획국내사가 개발한 고농도 휴미라(애브비) 바이오시밀러 '유플라이마'(셀트리온)가 미식품의약국(FDA)으로부터 허가받은지 석달만에 현지에 시판됐다고 회사 측은 17일 밝혔다.
회사 측은 자가면역질환 치료제 유플라이마의 80mg/0.8mL 용량 제형에 대해 최근 미국 판매를 시작, 작년 40mg에 이어 80mg도 시판됐다.
80mg은 자가면역질환을 진단받고 처음 처방을 받는 환자를 중심으로 사용될 예정이다. 40mg을 두 번 이상 투약해야 하는 첫 처방 환자 및 효과 감소로 투약 용량을 늘려야 하는 환자, 주사 공포증(trypanophobia)으로 고통받는 환자 등에게는 이 용량을 통해 투약 횟수가 줄어들게 되는 만큼 치료 편의성 측면이 개선된 데다, 환자와 의사 등 다양한 이해 관계자들의 니즈를 반영코자 40mg과 동일한 약가가 책정됐다고 회사 측은 설명했다.
아울러 회사 측이 오리지널약과의 상호교환성(interchangeability) 확보를 위해 FDA에 신청한 변경 허가도 유플라이마의 경쟁력 강화로 이어질 전망이다.
올해 1분기 내 회사 측은 소아 환자를 위한 유플라이마 20mg 용량 제형도 시장에 선보일 계획이다.
회사 측은 제품 경쟁력 강화와 더불어 환자 지원 프로그램(Celltrion CONNECT) 등 유플라이마의 판매 확대를 위한 다양한 마케팅 활동도 이어지고 있는데, 이 프로그램은 환자를 대상으로 사전 승인(prior authorization) 및 본인 부담금(copay)이 지원되며, 특정 조건에 부합하는 보험 환자, 보험 미가입자, 보험 지원이 충분하지 않은 환자 등에게 유플라이마가 지원되고 있다고 덧붙였다.
휴미라는 2022년 기준 매출 약 212억3,700만달러(약 27조6,081억원)로 집계됐다. 이 중 미국에서만 전체 매출의 87% 이상인 약 186억1,900만달러(24조2,047억원)를 기록했다.
셀트리온 토마스 누스비켈 미국 법인 최고상업책임자(CCO)는 “유플라이마는 오리지널약과 동일한 치료 효능, 안전성, 약동학 및 면역원성을 입증한 가운데 이번 80mg 추가를 통해 의사 및 환자에게 더 유연한 선택권과 편리한 자가 투여의 기회를 제공케 됐다”며 “용량 다양화를 통한 제품 경쟁력 강화를 바탕으로 보다 많은 환자들에게 유플라이마의 치료 혜택이 전달될 수 있도록 마케팅 활동을 적극적으로 이어 나갈 것”이라고 말했다. <저작권자 ⓒ 뉴스맥 무단전재 및 재배포 금지>
댓글
|
많이 본 기사
|